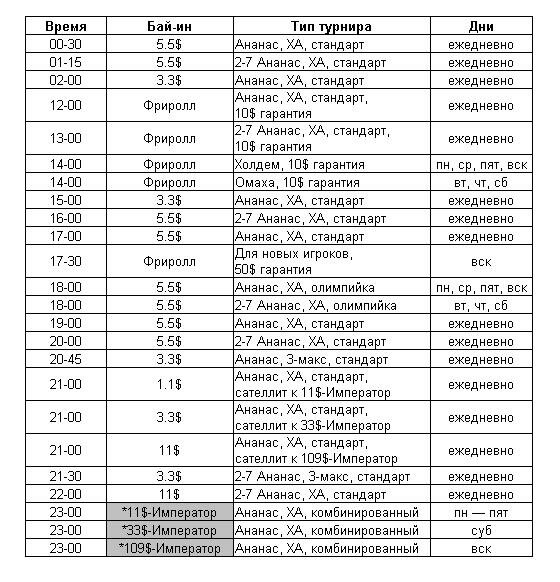
Новое расписание турниров на GamblerGames
С 5 мая на GamblerGames действует новое расписание турниров:
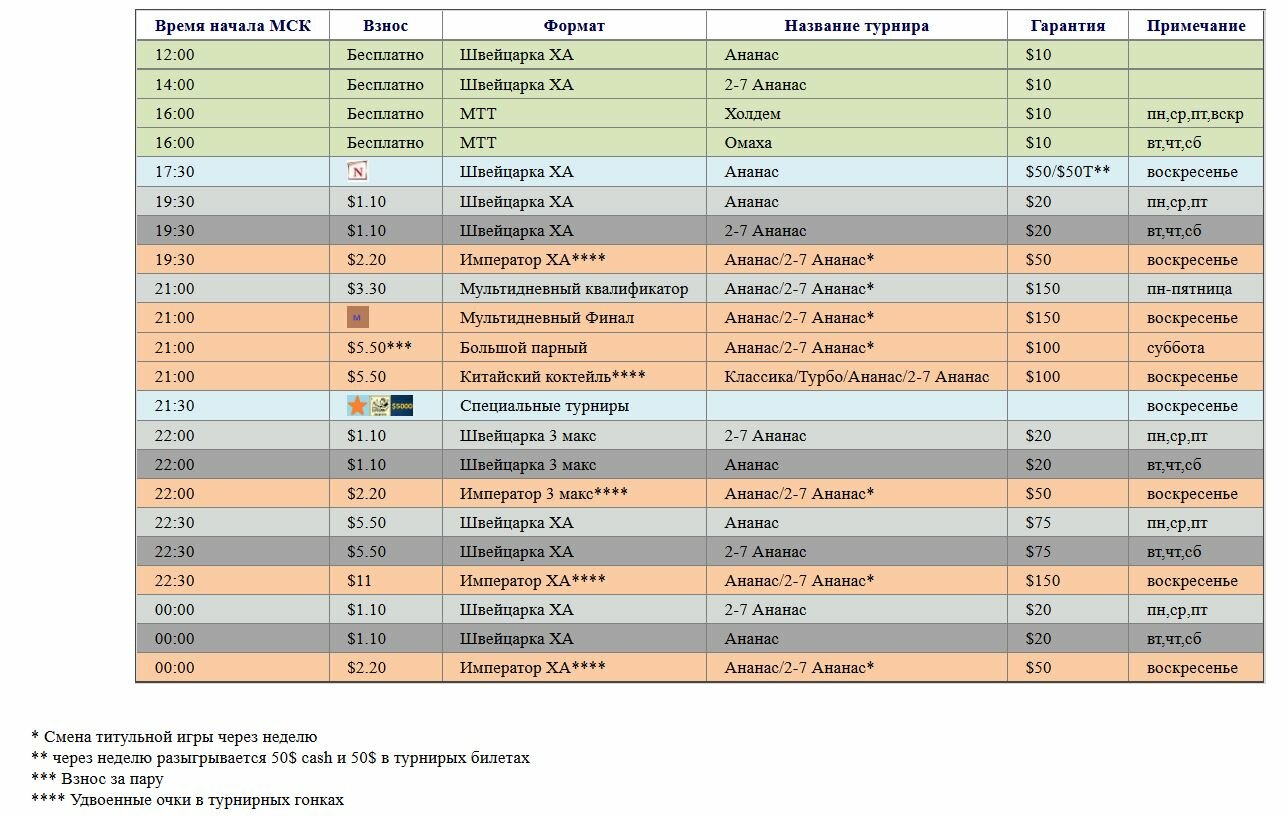
Также внесены изменения в регламент турниров. Теперь основным критерием определения победителя будет количество побед в турах, а сумма набранных кушей будет дополнительным показателем.
Еще одна приятная новость:
- Победители еженедельных турнирных гонок и ТОП-3 ежемесячной гонки;
- ТОП-3 турниров для новых игроков;
- Победители 5-ти любых турниров за месяц;
- Участники команд-победительниц турниров за месяц (включая парные)
получают билет на ежемесячный VIP Freeroll $5000 gtd
Новости | Нет комментариев